ALIMENTATORI MEDICALI

Il settore medicale per gli alimentatori switching è un campo di applicazione molto impegnativo e allo stesso tempo appagante per i progettisti più brillanti, perché sottopone l’R&D alla ricerca della migliore soluzione che estremizza i compromessi tipici di questi dispositivi, una sfida complessa dove l’esperienza accumulata negli anni è fondamentale per il successo e può fare la differenza rispetto le numerose prescrizioni normative.
Classicamente nei dispositivi medici lo spazio limitato e quindi le dimensioni compatte sono essenziali Es.GCS di XP Power, ma questo si contrappone alla gestione termica dell’alimentatore.
L’esigenza di raffreddare con minimo flusso d’aria e la necessità, nelle soluzioni più estreme, al raffreddamento a convezione naturale, in aggiunta a livelli di potenza elevati e spesso in ambienti dove il livello della temperatura può raggiungere valori critici per alcuni componenti vitali. Es. CCL400 XP Power & CUS150M TDK-Lambda
La ricerca di dimensioni compatte incide negativamente anche sui livelli di emissioni elettromagnetiche e loro margini rispetto agli standard imposti dalle normative; livelli di emissioni che sono mitigati da topologie di conversione sempre più raffinate per limitare il “peso” dei filtri che a loro volta impattano sulle correnti di dispersione, anche queste ultime normate con limiti. Es.QM TDK-Lambda
In certi casi è necessario prevedere il ricorso a soluzioni Classe II, senza protezione di terra, riducendo così drasticamente le correnti di dispersione
La sicurezza elettrica è senza dubbio il punto cruciale su cui si sviluppa l’intero progetto di questo settore aumentando le specifiche richieste per le applicazioni industriali e rendendo complemento quanto già introdotto in precedenza, complicando notevolmente le scelte.
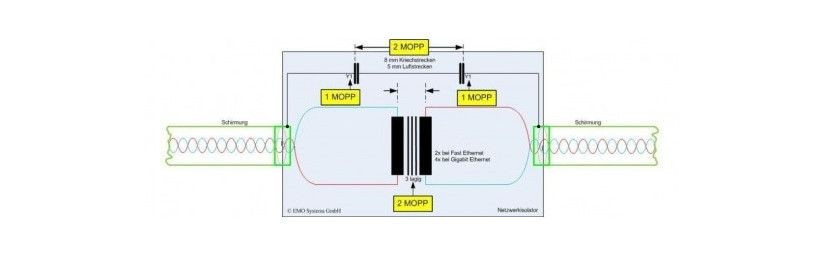
Il ricorso a isolamenti strutturati con doppie barriere di protezione 2xMoPP e 2xMoOP (Means of Patient/Operator Protection) rispettivamente protezione Paziente e Operatore semplifica l’inserimento in sicurezza dell’alimentatore e il rispetto delle normative a chi sviluppa il dispositivo medico completo e in riferimento all’utilizzo del device da un operatore medico con o senza parti applicate al paziente.
La norma IEC/EN/UL60601 stabilisce per le barriere di protezione i livelli di tensione le distanze in aria e superficiali (Cleareance/Creepage) nella forma basic e doppia/rinforzata, normalmente un produttore mette a disposizione lo schema di isolamento dell’alimentatore in fase di certificazione del dispositivo medico.
Stabilisce oltre al resto la corrente di dispersione massima ammissibile (Leakage) nelle condizioni normali (NC) e condizioni di singolo fault (SFC).
Con la terza edizione (Ed. 3) introduce il concetto di risk managment e l’implementazione di una procedura di gestione dei rischi secondo ISO14971.
Con la nuova edizione (Ed.4) si indirizza a migliorare l'immunità delle apparecchiature, in parte a causa della proliferazione di dispositivi di comunicazione wireless che operano all'interno della prossimità locale di ciò che può essere essenzialmente un equipaggiamento vitale. Questi dispositivi wireless possono essere ad esempio telefoni cellulari, dispositivi bluetooth, WiFi, RFID.
Introduce inoltre un elemento di analisi del rischio (risk managment) nel decidere quali livelli di immunità sono adatti per l'apparecchiatura, il suo ambiente operativo previsto e i livelli prevedibili di disturbi. Ciò è dovuto all'inclusione nello standard di apparecchiature destinate a funzionare al di fuori degli ambienti ospedalieri in cui c'è meno supervisione delle apparecchiature e meno controllo sui fenomeni elettromagnetici presenti. Parte dell'approccio al rischio è che i produttori devono essere chiari sul funzionamento essenziale del loro prodotto e attenuare il rischio di guasti o operazioni anomale o impreviste scegliendo i livelli di immunità appropriati.
Il sistema di gestione qualità più appropriato per i produttori di dispositivi per applicazioni mediche è conforme alla ISO 13485: 2016; certificati rispetto ai requisiti che dimostrano la capacità di fornire dispositivi per applicazioni mediche che soddisfano in modo coerente gli aspetti normativi di sicurezza, coinvolge la progettazione e lo sviluppo la produzione, stoccaggio e distribuzione.
XP Power
“La naturale mission critical dei dispositivi medicali richiede alta qualità, affidabilità e sicurezza. Il nostro obiettivo è quello di fornire sempre prodotti che soddisfino questi criteri e, per assicurare che possono centrare questi obiettivi, le fabbriche XP Power sono certificate secondo il Qualità Manufacturing System medicale ISO13485 e tutti i nostri prodotti sono progettati secondo standard rigorosi, nonché con fasi di test accurate. Utilizziamo il DFMEA (Design Failure Mode Effects Analysis), il PFMEA (Process Failure Mode Effects Analysis) e l’ISO14971 (gestione del rischio per i dispositivi medicali), per garantire che tutti i nostri prodotti siano il più sicuro e affidabili possibili.”
TDK-Lambda
ISO 13485:2003 and EN ISO 13485:2012 certification has been awarded to TDK-Lambda UK for its comprehensive quality management system for the design, manufacture, procurement, sales, distribution, product support and service of switch mode power supplies for medical applications.